Применение реакций окисления-восстановления в химическом анализе. Окислительно-восстановительные реакции Окислительно восстановительные реакции в качественном анализе
§ 1. Окисление-восстановление как один из основных методов химического анализа
Понятие о реакциях окисления - восстановления. Окисление - восстановление является одним из основных методов химического анализа и широко применяется в аналитической практике. Поэтому знание теории окислительно-восстановительных процессов для аналитика имеет большое значение. В этом параграфе, опуская подробности, мы лишь напомним некоторые основные понятия о реакциях окисления-восстановления, поскольку они подробно излагаются в курсе общей и неорганической химии. Основоположниками ионно-электронной теории реакций окисления-восстановления в СССР являются Я. И. Михайленко и Л. В. Писаржевский.
Окислением называют реакцию, связанную с потерей частицей (атомом, ионом или молекулой) электронов, а восстановлением - приобретение электронов.
Вещество, получающее электроны от окисляющегося вещества, называют окислителем, а отдающее электроны другому веществу, - восстановителем.
Реакции окисления и восстановления взаимно обусловлены, неразрывно связаны между собой и не могут рассматриваться изолированно друг от друга. Именно поэтому их называют реакциями окисления - восстановления (редокс-реакциями).
Реакции окисления - восстановления всегда связаны с переходом (отдачей или присоединением) электронов и сопровождаются изменением (увеличением или уменьшением) степени окисления элементов:
Окислители. В качестве окислителей в аналитических лабораториях чаще всего применяют: хлорную и бромную воду, , , , царскую водку.

Л. В. Писаржевский (1874-1938).
Кроме того, следует иметь в виду, что окислителями также являются ионы и некоторые другие.
Мерой окислительной способности данного окислителя (атома или иона) является сродство к электрону, представляющее собой энергию (работу, выражаемую в электрон-вольтах), которая высвобождается при присоединении к нему электрона (см. гл. III, § 27).
Восстановители. В качестве восстановителей применяет: металлические цинк, железо и алюминий, и т. п., восстановителями являются также ионы и др.
Мерой восстановительной способности данного восстановителя (атома или иона) является ионизационный потенциал (потенциал ионизации), численно равный энергии (работе, выражаемой в электрон-вольтах), которую нужно затратить для того, чтобы удалить от него электрон на бесконечно далекое расстояние (см. гл. III, § 27).
Реакции диспропорционирования (самоокисление - самовосстановление). Одно и то же вещество в зависимости, от условий реакции может быть и окислителем, и восстановителем Например:
В реакции (а) азотистая кислота является окислителем, в реакции (б) - восстановителем.
Вещества, проявляющие и окислительные, и восстановительные свойства, способны к реакциям самоокисления - самовосстановления. Такие реакции называют реакциями диспропорционирования. К реакциям диспропорционирования способны многие соединения.
Рассмотрим подробно окислительно-восстановительные свойства перекиси водорода, широко применяемой в аналитической практике.
Перекись водорода в силу специфического характера строения ее молекул Н-О-О-Н проявляет себя и как окислитель, и как восстановитель:

В реакциях с восстановителями она играет роль окислителя; а) в кислой среде

Под действием сильных окислителей она проявляет восстановительные свойства:
б) в кислой среде

Перекись водорода может проявлять восстановительные свойства не только в кислой (см. выше), но и в нейтральной, и в щелочной средах:

Известны также реакции, протекающие как в кислой, так щелочной и нейтральной средах, в которых перекись водорода является окислителем. Например: а) в кислой среде:

б) в нейтральной среде

в) в щелочной среде

Но, кроме того, известны такие реакции, в которых перекись водорода при сравнительно незначительном изменении среды играет роль то окислителя, например:

то восстановителя, например:

Вследствие двойственности окислительно-восстановительного характера перекиси водорода, она склонна вступать в реакции диспропорционирования:

Окислительно-восстановительные свойства металлов, неметаллов и образуемых ими ионов. Металлы являются восстановителями. Теряя свои электроны, атомы металлов превращаются в электроположительные ионы. Например:
Ионы металлов проявляют либо окислительные, либо восстановительные свойства. Приобретая электроны, ионы металлов переходят либо в ионы низшей зарядности (а), либо в нейтральное состояние (б):
Теряя электроны, ионы металлов превращаются либо в ионы высшей зарядности (а), либо в сложные ионы (б):
Неметаллы также могут проявлять и восстановительные, и окислительные свойства. Теряя электроны, атомы неметаллов превращаются в электроположительные ионы, образующие в водной среде окислы или сложные кислородсодержащие ионы. Например:
Приобретая электроны, атомы неметаллов превращаются в электроотрицательные ионы. Например:
Отрицательные ионы неметаллов являются восстановителями. Теряя электроны, отрицательные ионы неметаллов переходят либо в нейтральное состояние (а), либо в сложные ионы (б):
Подавляющее большинство сложных кислородсодержащих ионов несет отрицательные заряды, например некоторые ионы заряжены положительно: .
Сложные кислородсодержащие ионы, в состав которых входят электроположительные элементы, теряя свои электроны, превращаются в другие сложные ионы, содержащие те же элементы, но более электроположительной степени окисления. Например:
Приобретая электроны, сложные ионы превращаются в другие сложные ионы, в состав которых входят ионы элементов низшей валентности (а), в нейтральные молекулы (б) или в отрицательно заряженные ионы неметаллов (в):

Химическая связь. Химические реакции сопровождаются, как правило, изменением электронного строения атомов реагирующих элементов за счет полного перехода электронов (ионная связь), уменьшения или увеличения электронной плотности (поляризация), а также за счет обобществления пар электронов (ковалентная связь).
Деление веществ в зависимости от характера химической связи на ковалентные и ионные в известном смысле условно и основывается на преимущественном проявлении того или иного типа химической связи. Например, ионная и неполярно-ковалентная связи являются лишь крайними границами полярно-козалентной связи, которую можно рассматривать как отклонение от чисто ионной и ковалентной.
Подробное изложение теории химической связи не входит в нашу задачу, поскольку эти вопросы излагаются в курсах строения вещества, общей, неорганической и органической химии. Однако мы должны обратить внимание на то, что реакции окисления - восстановления можно рассматривать как реакции, сопровождающиеся переходом электронов от одних атомов, молекул и ионов к другим.
Составление уравнений окислительно-восстановительных реакций. При составлении уравнений реакций окисления - восстановления не имеет особого значения - происходит ли образование идеальной ионной связи. Это тем более несущественно, что даже ионное превращение элементов, связанное с переходом электронов от одних атомов к другим, не сопровождается, как известно, образованием идеальной ионной связи.
Существуют различные способы составления уравнений реакций окисления - восстановления. Ниже рассматривается ионно-электронный метод, основанный на составлении двух полуреакций: 1) полуреакции окисления и 2) полуреакции восстановления, и предусматривающий пользование студентами прилагаемыми в конце книги номограммами для определения направления реакции окисления - восстановления. С помощью этих номограмм можно без особого труда раздельно написать ионноэлектронные уравнения полуреакций и затем суммировать их в общее ионное уравнение реакции окисления - восстановления.
Балансирование полуреакций проводят с таким расчетом, чтобы общее число электронов, перешедших к окислителю, равнялось числу электронов, потерянных восстановителем.
Если представить себе все вещества, написанные в левой части 1-й полуреакции и 2-й полуреакции подсобного уравнения, как израсходованные на реакцию ("расход"), а написанные в правой части, как полученные в результате реакции ("приход"), то составление уравнения реакций в окончательном виде не составляет никаких трудностей. Для этого нужно лишь подвести итог (составить баланс).
Перед составлением уравнения, пользуясь указанными номограммами (см. Приложение) или таблицей окислительно-восстановительных потенциалов (см. табл. 5, стр. 96), нужно решить основной вопрос пойдет ли данная реакция или не пойдет.
Это необходимо делать потому, что многие реакции, уравнения которых можно сбалансировать, т. е. написать на бумаге, на самом деле при данных условиях практически не идут.
Например, не идет реакция
но идет обратная реакция
Идут реакции:

а обратные им реакции в тех же условиях практически не протекают.
Рассмотрим следующую реакцию окисления - восстановления:
Подсобное уравнение
Нетрудно заметить, что уравнение реакции окисления - восстановления в полной форме является результатом суммирования двух полуреакций.
В этом примере ионы высшей степени окисления с освобождающимися ионами кислорода образуют в кислой среде соответственно нерастворимую в воде метаоловянную кислоту и бисульфат-ион , а ионы водорода с ионами кислорода в кислой среде образуют молекулы воды.
В молекулярной форме приведенная выше реакция может быть представлена так:
В общем виде при составлении правой части ионно-электронного уравнения реакции окисления - восстановления необходимо руководствоваться следующими правилами
В отношении ионов водорода
1) с освобождающимися (а) или образующимися (б) ионами кислорода или ионами гидроксила (в) ионы водорода образуют нейтральные молекулы боды:
2) с ионами фтора, серы, селена, теллура, азота и других элементов, находящихся в состоянии низших степеней окисления, ионы водорода образуют соответствующие слабые электролиты:
3) с нейтральными молекулами воды и аммиака ионы водорода образуют ионы гидроксония и аммония.
В отношении ионов гидроксила
1) в процессе окисления соединений элементов низших степеней окисления в высшие степени окисления, в присутствии ионов гидроксила образуются кислородные соединения элементов высших степеней окисления и вода:
2) с элементами, склонными к образованию нерастворимых в воде гидроокисей, ионы гидроксила образуют осадки гидроокисей:
3) при окислении элементов, склонных к комплексообразованию, ионы гидроксила образуют с ними гидроксокомплексные ионы:
4) с ионами водорода и ионами аммония ионы гидроксила соответственно образуют молекулы воды (а) и аммиака (б):
В отношении молекул воды
1) с освобождающимися (а) или образующимися (б) ионами кислорода молекулы воды образуют гидроксильные ионы:
2) в процессе окисления ионов элементов низших степеней окисления в высшие молекулы воды образуют комплексные кислородсодержащие ионы (а) и нерастворимые в воде соединения (б), а также ионы водорода:
3) в процессе восстановления соединений элементов высшей степени окисления в низшие степени окисления в присутствии воды образуются соединения элементов низших степеней окисления (а), нерастворимые в воде соединения (б) и ионы гидроксила:
В отношении остальных ионов
1) одно-, двух- и трехзарядные ионы металлов, склонные давать нерастворимые соединения, в нейтральной или кислой среде образуют с кислотными остатками нерастворимые соли, например:
Следует иметь в виду, что свободные (или гидратированные) катионы, несущие свыше трех положительных зарядов, как правило, в водных растворах не существуют. Высокозарядные ионы в процессе разнообразных реакций окисления - восстановления, реагируя с водой, моментально соединяются с ионами кислорода воды, образуя сложные кислородсодержащие ионы типа :

Применение реакций окисления - восстановления в аналитической химии. Реакции окисления - восстановления широко применяются в химическом анализе.
1. Для перевода ионов и соединений элементов низших форм окисления в высшие (а) и высших форм в низшие (б) с целью предотвращения их вредного влияния в процессе проведения анализа:
а) для предварительного окисления до в тех случаях, когда ионы железа (II) мешают ходу анализа;
б) для восстановления в процессе осаждения в хлористоводородном растворе сероводородом .
2. Для обнаружения ионов, дающих характерные реакции с окислителями или восстановителями, например:

3. Для разделения ионов, окисляющихся или восстанавливающихся с образованием малорастворимых соединений, например:
4. Для количественного определения многих неорганических и органических соединений весовым или объемным методом (см. книга 2).

Окислительно-восстановительные реакции являются самыми распространенными и играют важную роль в природе и технике. Дыхание и обмен веществ живых организмов, коррозия металлов, горение топлива - это примеры окислительно-восстановительных реакций. С помощью ОВР получают металлы, щелочи, кислоты и многие другие ценные продукты. ОВР используют для очистки веществ, природных и сточных вод, газовых выбросов предприятий. Окислители и восстановители, образующие окрашенные растворы, широко применяют для анализа различных веществ методом титрования. С упрощенным вариантом метода анализа вы познакомитесь в данной работе.
Экспериментальная часть
Опыт 1. Влияние рН среды на характер протекания окислительно-восстановительной реакции
Известны соединения
марганца, содержащие этот элемент в
различных степенях окисления:
, ,
, ,
, .
Этивещества
проявляют различные окислительно-восстановительные
свойства и окрашивают растворы в разные
цвета:
.
Этивещества
проявляют различные окислительно-восстановительные
свойства и окрашивают растворы в разные
цвета:
 в темно-малиновый,
в темно-малиновый, - в зеленый,
- в зеленый, образует бесцветный раствор,
образует бесцветный раствор, выпадает в виде бурого осадка.В химических
реакциях
выпадает в виде бурого осадка.В химических
реакциях
 восстанавливается до одного из указанных
веществ в зависимости от кислотности
среды.
восстанавливается до одного из указанных
веществ в зависимости от кислотности
среды.
Для оценки влияния
рН среды на окислительные свойства
перманганата калия в три пробирки
налейте по 2-3 мл раствора сульфита натрия
 .В одну
пробирку добавьте 1 мл раствора
.В одну
пробирку добавьте 1 мл раствора
 ,
во второй пробирке оставьтераствор соли
нейтральным, в третью пробирку добавьте
1 мл раствора
,
во второй пробирке оставьтераствор соли
нейтральным, в третью пробирку добавьте
1 мл раствора
 .
В каждуюпробирку
внесите одинаковое количество (2-3 мл)
раствораперманганата
калия
.
В каждуюпробирку
внесите одинаковое количество (2-3 мл)
раствораперманганата
калия
 .
.
Отметьте изменение
окраски растворов и напишите схемы
реакций, протекающих в разных средах.
Определите степень окисления Mn
в его соединениях, расставьте коэффициенты
в уравнениях. Сделайте вывод о влиянии
рН среды на окислительные свойства
 .
.
Опыт 2. Определение содержания железа( II ) в его соли методом перманганатометрии
Метод перманганатометрии
применяется для количественного
определения веществ, способных окисляться,
и основан на изменении окраски соединений
Mn
при изменении его степени окисления.
При титровании подкисленного раствора
определяемого вещества раствором

 восстанавливается до
восстанавливается до ,
что сопровождается обесцвечиванием
раствора соли марганца. Когда исследуемое
вещество прореагирует полностью, от
одной капли прилитого раствора
,
что сопровождается обесцвечиванием
раствора соли марганца. Когда исследуемое
вещество прореагирует полностью, от
одной капли прилитого раствора появляется слабое розовое окрашивание.
Появлениеокраски
свидетельствует об окончании реакции
и наличии незначительного избытка
реактива.
появляется слабое розовое окрашивание.
Появлениеокраски
свидетельствует об окончании реакции
и наличии незначительного избытка
реактива.
Определив
экспериментально количество
израсходованного
 ,
можно по закону эквивалентов рассчитать
количество исследуемого вещества.
,
можно по закону эквивалентов рассчитать
количество исследуемого вещества.
Количественное
определение двухвалентного железа
основано на том, что в кислой среде ион
 легко окисляется перманганатом до иона
легко окисляется перманганатом до иона .Реакция,
протекающая в процессе титрования
раствора соли двухвалентного железа,
выражается следующей схемой:
.Реакция,
протекающая в процессе титрования
раствора соли двухвалентного железа,
выражается следующей схемой:
Для выполнения
работы взвесьте на аналитических весах
с точностью до 0,0002 г (на часовом стекле)
несколько кристаллов сульфата железа
 ,
известного под названием железный
купорос. Запишите массу соли в тетрадь.
Пересыпьте соль в коническую колбу,
налейте в нее 50 мл раствора серной
кислоты, и, осторожно перемешивая,
дождитесь растворения соли.
,
известного под названием железный
купорос. Запишите массу соли в тетрадь.
Пересыпьте соль в коническую колбу,
налейте в нее 50 мл раствора серной
кислоты, и, осторожно перемешивая,
дождитесь растворения соли.
В бюретку с помощью
воронки налейте раствор
 известной концентрации; под бюреткуподставьте
стакан. Подняв кончик бюретки выше
уровня зажима, вытесните воздух и
заполните его раствором. Установите
уровень раствора в бюретке на нулевой
отметке (для темных жидкостей это
делается по верхнему краю мениска).
известной концентрации; под бюреткуподставьте
стакан. Подняв кончик бюретки выше
уровня зажима, вытесните воздух и
заполните его раствором. Установите
уровень раствора в бюретке на нулевой
отметке (для темных жидкостей это
делается по верхнему краю мениска).
Держа колбу с
раствором
 в руке, при
постоянном перемешивании добавляйте
небольшими порциями раствор
в руке, при
постоянном перемешивании добавляйте
небольшими порциями раствор
 до появления слабо розового окрашивания.
По окончании титрования запишите в
тетрадь объем израсходованного раствора
перманганата калия.
до появления слабо розового окрашивания.
По окончании титрования запишите в
тетрадь объем израсходованного раствора
перманганата калия.
Напишите уравнение реакции, определите число электронов, отдаваемых ионом железа, и рассчитайте молярную массу его эквивалента по формуле (1):
 (1)
(1)
Массу окисленного
железа рассчитайте, используя закон
эквивалентов
:
число
эквивалентов
 равно числу эквивалентов
равно числу эквивалентов ,
поэтому в
данном случае выполняется равенство:
,
поэтому в
данном случае выполняется равенство:
 , (2)
, (2)
где
 - масса окисленного железа, г;
- масса окисленного железа, г;
 –молярная масса
эквивалента
–молярная масса
эквивалента
 ,
г/моль;
,
г/моль;
 (
( )–молярная
концентрация эквивалента
)–молярная
концентрация эквивалента ,
моль/л;
,
моль/л;
 (
( )–объем
раствора
)–объем
раствора ,
л, определенный экспериментально.
,
л, определенный экспериментально.
Из выражения 2 найдите массу окисленного железа:
Процентное содержание железа в соли рассчитайте по формуле:
 (4),
(4),
где
 –
масса анализируемой соли, г.
–
масса анализируемой соли, г.
Экспериментально полученное значение массовой доли железа в его соли сравните с расчетным значением.
Лекция № 4.
Окислительно-восстановительные равновесия в растворах электролитов.
План.
1. Окислительно-восстановительные (ОВ) реакции и их применение в аналитической химии.
2. Константа равновесия окислительно-восстановительных реакций.
3. Влияние разных факторов на величину электродного потенциала.
1. Окислительно-восстановительные (ОВ) реакции и их применение в аналитической химии
Окислительно-восстановительные реакции – это реакции, которые сопровождаются переходом электронов от одних частиц (атомов, молекул и ионов) к другим, что приводит к изменению степеней окисления элементов.
Окисление – это процесс, при котором происходит от дача электронов атомом, молекулой или ионом:
Na 0 – ē → Na +
H 2 O 2 - 2ē → 2H + + O 2
SO 3 2- + 2OH - - 2ē → SO 4 2- + H 2 O
Восстановление – это процесс, при котором происходит присоединение электронов атомом, молекулой или ионом:
S 0 + 2ē → S 2-
H 2 O 2 + 2H + + 2ē → 2H 2 O
Cr 2 O 7 2- + 14H + + 6ē → 2Cr 3+ + 7H 2 O
MnO 4 - + 8H + + 5ē → Mn 2+ + 4H 2 O
В качестве восстановителей в аналитической химии чаще всего применяют: H 2 O 2 , SnCl 2 , H 2 S, H 2 SO 3 , Na 2 S 2 O 3 ; в качестве окислителей – Cl 2 ; Br 2 ; H 2 O 2 ; K 2 Cr 2 O 7 ; KMnO 4 ; HNO 3 и другие.
В реакциях окисления-восстановления всегда участвуют два вещества, одно из которых является восстановителем, а другое окислителем. При этом количество электронов, принятых окислителем, всегда должно быть равно количеству электронов, отданных восстановителем.
Типы окислительно-восстановительных реакций
К основным типам окислительно-восстановительных реакций относятся следующие:
1 – межмолекулярные окислительно-восстановительные реакции (элементы, изменяющие степень окисления, находятся в составе разных молекул):
2-1+6-2
PbS + 4H 2 O 2 → ↓PbSO 4 + 4H 2 O
восстановитель окислитель
1 +1 0
NaCl + NaClO +H 2 SO 4 → Cl 2 + Na 2 SO 4 + H 2 O;
2 – внутримолекулярные окислительно-восстановительные реакции (элементы, изменяющие степень окисления, входят в состав одной молекулы):
3 +5 +1
NН 4 NО 3 → N 2 O + 2H 2 O
3 +6 0 +3
(NН 4) 2 Cr 2 О 7 → N 2 + Cr 2 О 3 + 4H 2 O;
3 – реакции диспропорционирования (самоокисления-самомовосстановления) (атомы одного и того-же элемента по-разному изменяют степень окисления):
0 -1 +1
Cl 2 + 2NaO Н → NaCl + NaClO + H 2 O
1 -2 0
2Н 2 О 2 → 2H 2 O + O 2
В общем виде окислительно-восстановительный процесс выражается следующим образом:
Ox+ne Û Red
Окисл.Восстан.
формаформа
Ox и Red взаимосвязаны и это есть окислительно-восстановительная пара (редоксипара).
Fe 3+ +1e Û Fe 2+
Cu 2+ +2e Û Cu 0
OxRed
Уравнение Ox + ne Û Red изображает окислительно-восстановительный переход или окислительно-восстановительную полуреакцию.
Переход может быть обратимым или необратимым.
2JO 3 - +12H 3 O + +10e=J 2 0 ¯ +18H 2 O
Ag 2 O+H 2 O+2e=2Ag 0 ¯ +2OH -
2- +2e=Hg 0 ¯ +4Cl - .
Таким образом, редоксипара, то есть совокупность окисленной формы с соответствующей восстановленной формой, владеют определенными редоксспособностями. Они обусловлены способностью окисленной формы присоединить электроны и восстановленной формы их отдавать. Для количественной оценки редоксспособностей обратимых редоксипар используют электродные потенциалы.
В любой ОВ реакции принимают участие не менее двух редокспар – не меньше одного окислителя и одного восстановителя. Продукты реакции являются новыми окислителем и восстановителем (более слабым, чем первоначальные):
Ox 1 +Red 2 Û Red 1 +Ox 2
2Fe 3+ +Sn 2+ Û 2Fe 2+ +Sn 4+ .
Наблюдается аналогия с кислотно-основными реакциями:
Кислота 1+основание 2 Û основание 1+кислота 2.
Это есть электронная теория ОВ реакций. Возможность протекания ОВ ре а кций определяется химической активностью редоксипар, которые принимают участие в ней. Химическую активность редоксипары характеризуют величиной стандартного (нормального) окислительно-восстановительного потенциала Е 0 .
Стандартный (нормальный) окислительно-восстановительный потенциал пар, которые являются растворимыми формами, - это разница потенциалов, которая возникает между стандартным водородным и неактивным (платиновым) электродом, погруженным в раствор, который содержит окисленную и восстановленную формы одной редокс-пары (при 25 ° С и активности компонентов пары, равных 1 моль/дм 3).
Например, для определения потенциала пары Sn 4+ /Sn 2+ собирают гальванический элемент:
(-) Pt (H 2) / H 2 SO 4 // Sn 4+ /Sn 2+ / Pt (+);E 0 Sn4+/Sn2+ =+0.15 B.
То есть потенциал измеряют в электрохимической ячейке типа гальванического элемента, которая состоит из стандартного и индикаторного электрода, на котором проходит электрохимическая реакция восстановления или окисления компонента редокс-пары. Измерение потенциала индикаторного (чаще Pt) электрода проводят относительно стандартного (нормального) водородного электрода. Он представляет собой платиновый электрод, погруженный в 1 н раствор H 2 SO 4 (или 1,25 М НСl). Через раствор пропускают водород под давлением 101,3 кПа при комнатной температуре. На электроде проходит реакция:
2Н + +2е Û Н 2
и возникает потенциал окислительно-восстановительной пары 2Н + /Н 2 , который условно принято за нуль. По отношению к этому электроду измеряют потенциал других окислительно-восстановительных пар. Фактически в электрохимической ячейке измеряют разницу потенциалов между индикаторным и стандартным водородным электродами. ОВ пара может состоять из форм, которые находятся в одном агрегатном состоянии, например жидком - Fe 3+ /Fe 2+ , и в разных, например , жидком и твердом – Zn 2+ /Zn 0 . В зависимости от этого определение стандартного ОВ потенциала разных пар несколько отличается из-за разной техники его измерения.
Стандартный (нормальный) ОВ потенциал Е 0 пар, которые содержат электронейтральный металл, - это разница потенциалов, которые возникают между металлом, погруженным в раствор своей соли (с активностью иона металла 1 моль/л) и стандарным водородным электродом при 25 ° С.
Стандартный потенциал редокс-системы используют в качестве объективной характеристики окислительно-восстановительных свойств соединений. Чем больше положительное значение стандартного потенциала, тем сильнее окислитель. В тоже время восстановленные формы сильных окислителей обладают слабо выраженными восстановительными свойствами и, наоборот, окисленные формы сильных восстановителей обладают слабыми окислительными свойствами. Таким образом, окислительно-восстановительные реакции протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Сравнение величин стандартных потенциалов может быть использовано для предсказания направления окислительно-восстановительной реакции.
Oднако следует учитывать, что стандартные потенциалы могут значительно отличаться от реальных и направление реакции может меняться.
Для определения потенциала пары Е 0 (Zn 2+ /Zn 0) составляют гальваничный элемент:
(-) Zn / ZnSO 4 // H 2 SO 4 / (Н 2) Pt (+)
А(-): Zn 0 ® Zn 2+ + 2е;
К(+): 2Н + + 2е ® Н 2 0 .
Если электроны переходят от водородного электрода к металлическому, то потенциал берется с положительным знаком; если ж – к водородному, то потенциал пары условно принимают за отрицательную величину.
По значению и при сравнении Е 0 редокспары можна определить принципиальную возможность прохождения ОВ реакции. Например, сравнение значений Е 0 при взаимодействии пар Fe 2+ /Fe (Е 0 =-0,44 B) и Cu 2+ /Cu (Е 0 =+0,34 В) показывает, что окислителем везде будет форма Cu 2+ , восстановителем – Fe, так как потенциал второй системы больше потенциала первой системы:
Cu 2+ + Fe ® Fe 2+ + Cu.
Направление прохождения реакции зависит от значения электродвижущей силы (ЭДС):
ЭДС=Е 0 (окислителя) - Е 0 (восстановителя).
Если ЭДС > 0, то проходит прямая реакция. Если ЭДС < 0, то – обратная раекция.
В случае Fe и Cu 2+ :ЭДС=+0,34-(-0,44)=+0,78 В. Чем больше ЭДС, тем энергичнее проходит взаимодейтвие.
Стандартные ОВ потенциалы определяют при активности равной 1 моль/л. При других значения активности потенциалы необходимо рассчитывать по уравнению Нернста-Перерса:
Ln
®
lg,
t=25
°
С, то ![]()
При а Ох =а Red Е=Е 0 .
В том случае, если одна из форм находится в твердой или газообразной фазах, то в уравнение Нернста подставляют только значения активности формы, которая находится в жидкой фазе:
Е(Fe 2+ /Fe 0) ![]()
E(Cl 2 /2Cl -) ![]()
Если при переходе одной формы в другую принимают участие ионы или молекулы воды, то их тоже вводят в состав окисленной или восстановленной форм. Составляют электронно-ионное уравнение окисления или восстановления:
MnO 4 - + 8H + + 5e = Mn 2+ + 4H 2 O.

SnO 3 2- + H 2 O + 2e =SnO 2 2- + 2OH - .

Применение:
Окислительно-восстановительные реакции широко используются в качественном и количественном анализе.
В качественном анализе окислительно-восстановительные реакции используются для:
Переведения соединений из низших степеней окисления в высшие и наоборот;
Переведения малорастворимых соединений в раствор;
Обнаружения ионов;
Удаления ионов.
Так реакции окисления пероксидом водорода в щелочной среде используются в анализе катионов IV аналитической группы для переведения соединений Sn(II), As(III), Cr(III) в гидроксо- и оксоанионы этих элементов в высших степенях окисления.
1. Для перевода ионов и соединений элементов с низшими степенями окисления в высшие и наоборот:
а) Fe 2+ в Fe 3+ ,
б) Аs V в As III .
2. Для открытия ионов, которые дают характерные реакции с окислителем или восстановителем:
H + As III Ag +
М n 2+ MnO 4 - As -3 H 3 As +3
H 2 OMnO 2 As V
3. Для отделения ионов, которые окисляются или восстанавливаются с образованием малорастворимых соединений.
H 2 O 2
Мn 2+ MnO 2 ¯ .
ОН -
4. В количественном определении.
Окислительно-восстановительные реакции широко используют не только в качественном анализе катионов, но и в анализе анионов.
Так в ходе анализа на анионы выполняют пробу на анионы-окислители (Cr2O72-, AsO43-, NO3-) действием раствора KI в кислой среде в присутствии хлороформа. При этом образуется свободный йод, окрашивающий слой хлороформа в красно-фиолетовый цвет.
Кроме того, проводят пробу на анионы-восстановители (C 2 O 4 2- , S 2 O 3 2- , S 2- , SO 3 2- , AsO 3 3- , I - , NO 2 -), основанную на обесцвечивании раствора йода в слабокислой среде (за исключением AsO 3 3- , которые обнаруживают в слабощелочной среде).
На окислительно-восстановительных реакциях основана проба с концентрированной H 2 SO 4 (Cl - , Br - , I - , CrO 4 2- , NO 3 - , SO 3 2- , S 2 O 3 2- и др.), при этом выделяются газообразные продукты (Cl 2 , I 2 , CO 2 и др.).
Для обнаружения таких анионов-восстановителей, как SO 3 2- и C 2 O 4 2- , NO 2 - используют реакции, в результате которых обесцвечиваются растворы KMnO4 .
2. Константа равновесия окислительно-восстановительных реакций.
Во многих случаях необходимо знать не только направление окислительно-восстановительной реакции, но и насколько полно она протекает. Так в количественном анализе используют те реакции, которые практически протекают на 100 % (или приближаются к этому). Степень протекания реакции определяется константой равновесия.
Глубина прохождения ОВ реакции определяется константой равновесия:
аОх 1 + bRed 2 = aRed 1 + bОх 2 .
аОх 1 + ne = aRed 1 .
bRed 2 + ne = bОх 2 .


При равновесии Е 1 =Е 2



½½
К равнов.
Поэтому 
 К равнов. = .
К равнов. = .
n-общее число электронов, которые принимают участие в реакции. Реакции, которые проходят полностью, должны иметь константу больше 10 8 (при условии связывания 99,99 % исходных веществ).
То есть,  .
.
D Е 0 ³ + 0,4 В (n=1)
D Е 0 ³ + 0,2 В (n=2)
Из последнего уравнения следует, что чем больше разность потенциалов (E 0 Ox - E 0 Red), тем больше константа равновесия и тем полнее будет протекать реакция слева направо. Однако следует помнить, что большое значение константы равновесия не свидетельствует о высокой скорости протекания процесса.
На скорость протекания реакции оказывают влияние такие факторы, как механизм реакции, концентрация реагентов, температура раствора, наличие катализаторов или ингибиторов.
Скорость реакции возрастает при увеличении концентрации реагентов, а также при повышении температуры. Обычно увеличение температуры на 10° приводит к ускорению реакции в 2-4 раза. Так, например, при взаимодействии перманганата калия с раствором щавелевой кислоты реакция идет медленно и для ее ускорения раствор подогревают.
Кроме того, эта реакция относится к автокаталитическим (катализатором является один из продуктов реакции – ионы Mn 2+).
В ряде случаев имеют место так называемые сопряженные или индуцированные окислительно-восстановительные реакции.
Например, при окислении перманганатом калия ионов Fe 2+ в растворе, подкисленным соляной кислотой, часть перманганата калия расходуется на окисление хлорида:
2MnO 4 – + 10Cl – + 16H + ® 2Mn 2+ + 5Cl 2 + 8H 2 O.
В отсутствие ионов Fe 2+ эта реакция не происходит, хотя разность стандартных потенциалов позволяет ее протекание. Для предотвращения побочной реакции указанный процесс проводят в растворах, подкисленных серной кислотой.
3. Влияние разных факторов на величину электродного потенциала.
На величину реального потенциала оказывают влияние такие факторы, как рН среды, концентрации реагентов, комплексообразование, образование осадков и др.
Следует отметить, что рН среды оказывает влияние на реальный потенциал не только в тех случаях, когда концентрации Н+ и ОН- ионов входят в уравнение Нернста, но иногда и в случаях их отсутствия в этом уравнении.
Это может быть связано с изменением формы существования ионов в растворе (влияние на гидр о литические и другие равновесные процессы).
Как отмечалось потенциал редокс-пары Е 0 MnO4-/Mn2+ зависит от концентрации ионов водорода (указанная величина может изменяться от 1,51 В до 1,9 В), в связи с чем это свойство используют для фракционированного окисления галогениданионов до свободных галогенов.
Так при рН от 5 до 6 перманганат окисляет лишь йодиды (Е 0 I2/ 2I- = 0,53 B), при рН 3 окисляются бромиды (Е 0 Br2/2Br- = 1,06 B) и только при значительно более высокой кислотности окисляются хлориды (Е 0 Cl2/2Cl- = 1,395 B).
1) влияние ионной силы раствора.
Изменение ионной силы раствора вызывают изменения коэффициентов активности ионов. Заряд иона окисленной формы обычно отличается от заряда восстановленной формы, поэтому их активности изменяются по-разному. Если при этом отношение активностей в формуле Нернста увеличивается, то редокспотенциал увеличивается и наоборот.
Влияние ионной силы раствора удобно учитывать путем применения реальных потенциалов.
Для приблизительных расчетов часто применяют формулу:
![]() , то есть вместо реального стандартного потенциала берут
нормальный стандартный ОВ потенциал.
, то есть вместо реального стандартного потенциала берут
нормальный стандартный ОВ потенциал.
2) влияние концентрации компонентов редокспары.
Из уравнения
Нернста видно, что Е=f(C Ox , C Red). Увеличение C Ox
и уменьшение C Red приводит к увеличению потенциала и наоборот. Если
окисленной формы в 100 раз больше концентрации восстановленной формы, то
потенциал превышает реальный стандартный потенциал на ![]() В.
В.
Так, изменение соотношения концентраций вызывает относительно небольшое изменение потенциала. Поэтому можно сказать, что главную роль в значении потенциала играет реальный стандартный потенциал, то есть химическая природа компонентов редокспары .
3) влияние рН раствора.
В большинстве случаев в водных растворах в редокспереходах принимают участие ионы гидроксония или гидроксид-ионы. При этом ионы гидроксония принимают участие в процессах восстановления окисленной формы:
Ox + аН + + ne= Red + n/2 Н 2 О,
а гидроксид-ионы – в процессах окиснення восстановленной форме:
Ox + а/2 Н 2 О + ne= Red + аОН - .
В обоих случаях при учете влияния рН раствора удобно пользоваться реальными стандартными потенциалами:
 где
где
Чем ниже рН раствора, тем выше реальный стандартный потенциал, то есть тем более сильным окислителем является окисленная форма. Значение потенциала пары в этих условиях зависит от соотношения концентраций обеих форм редокспары:
![]()
Существует следующее правило для создания реакционной среды, необходимой для оптимального течения процесса: если в результате окислительно-восстановительной реакции накапливаются H + или ОН – - ионы, то необходимо создать среду, которая обладает противоположными свойствами (щелочную или кислую соответственно).
Кроме того, для реакции нужно брать компоненты (окислитель и восстановитель), которые реагируют в одинаковой среде. В противном случае может иметь место торможение процесса.
Если в редокспереходе принимают участие гидроксид-ионы, то имеем:
![]()
5) влияние комплексообразования.
Это влияние очень существенно. Например, в случае титрования ионов Fe 2+ бихроматом добавлением Н 3 РО 4 позволяет связыватьокисленную форму Fe 3+ в комплекс, вследствии чего очень увеличивается величина скачка титрования.
Колличественные характеристики влияния будут рассматриваться при изучении реакций комплексообразования.
Окислительно-восстановительные реакции нашли широкое применение в аналитической химии для обнаружения ионов (см. опыт 4, 5, 18, 29), для электролитического разделения элементов и количественного определения, особенно в титриметрическом анализе (см.опыты 11, 56)
НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Направление и полнота окислительно-восстановительной реакции определяется константой равновесия
Равновесный потенциал (Е) связан со стандартным окислительно-восстановительным потенциалом следующим образом (уравнение Нернста):
При образовании малорастворимых соединений
Если заменить активности равновесными концентрациями потенциалопределяющих ионов (ао = f или ав = f[B]), тогда получим
Сумма первых двух членов правой части уравнения соответствует реальному потенциалу полуреакции
(Следовательно, реальный потенциал изменяется в за* симости от ионной силы раствора.

Для сложной системы изменение потенциала связано с влиянием различных факторов (ионной силой раствора, комплексообразованием, диссоциацией, ассоциацией, гилоатаиией и nv>.) :
где В, А - лиганды, включая Н+ и ОН".
Потенциал для такой системы составляет:

Рис. VIII-2. Диаграмма стандартных окислительно-восстановительных потенциалов (в вольтах).
Eр зависит от концентрации лиганда, Н+, ионной силы и т. п.
Для аналитических целей важны именно реальные потенциалы, позволяющие предвидеть направление химических реакций в растворе; значение их можно определить непосредственно экспериментальным путем.
Реакции, протекающие ступенчато с образованием промежуточных продуктов, и особенно электрохимические реакции, не полностью обратимые, характери-* зуются смешанным потенциалом .
Стандартные потенциалы пар измеряются относительно потенциалов электродов сравнения, например стандартного водородного электрода или каломельного полуэлемента . На лекции можно показать рисунки с изображением электродов сравнения (рис. VIII-1). На демонстрационный стол следует поставить потенциометри-ческую установку для измерения потенциалов, а также представить наглядную диаграмму со значениями стандартных потенциалов некоторых окислительно-восстановительных пар (рис. VII1-2) .
Окислительно-восстановительные реакции широко используются в качественном и количественном анализе.
В качественном анализе окислительно-восстановительные реакции используются для:
Переведения соединений из низших степеней окисления в высшие и наоборот;
Переведения малорастворимых соединений в раствор;
Обнаружения ионов;
Удаления ионов.
6.Растворимость. Произведение растворимости. Факторы, влияющие на растворимость труднорастворимых электролитов.
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше.
Концентрация каждого иона в насыщенном растворе электролита может быть изменена, но при этом изменяется и концентрация другого иона так, что произведение концентраций сохраняет прежнюю величину. Поэтому, если в насыщенный раствор электролита ввести некоторое количество одного из ионов, входящих в состав электролита, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть растворимость электролита понижается от введения в раствор одноименных ионов. Произведение растворимости (ПР, Ksp) - произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости - величина постоянная.
7.. Условия образования и растворения осадков. Дробное осаждение и разделение.
ДРОБНОЕ ОСАЖДЕНИЕ - способ разделения смсси веществ, близких по химич. свойствам и растворимости. Д. о. состоит в последовательном переводе компонентов смеси в осадок отдельны.ми порциями (фракция.ми). При добавлении осадителя к смеси двух солей в растворе в первую очередь осаждается компонент, образуюищй наименее растворяемое соединение. Затем, когда большая часть его будет в осадке и отношение концентраций иопов компонентов достиг-иет значеиия, равного отношению произведений растворимости образующихся соединений, в осадок начнет переходить также и второй компонент, причем каждая последую1цая фракция осадка будет богаче вторым и беднее первым компонентом. Возможность полного разделения смеси двух веществ зависит от соотношений первоначальных концентраций их в растворе, а также от значений произведений растворимости соответствующих соединений.
8.. Реакции осаждения и их применения в фармацевтическом анализе. Гетерогенные процессы
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ - константа равновесия гетерогенной реакции растворения (или обратной реакции осаждения) малорастворимой соли в определенном растворителе. Процессы образования и растворения осадков имеют большое практическое значение для различных отраслей науки и промышленности. Константа равновесия реакции растворения, называемая произведением растворимости ПР, является произведением концентраций соответствующих ионов в насыщенном растворе.
Представительность пробы; взаимосвязь с объектом и методом анализа. Факторы, обусловливающие размер и способ отбора представительной пробы. Отбор проб гомогенного и гетерогенного состава. Способы получения средней пробы твердых, жидких и газообразных веществ; устройства и приемы, используемые при этом; первичная обработка и хранение проб; дозирующие устройства.
Основные способы перевода пробы в форму, необходимую для конкретного вида анализа: растворение в различных средах; спекание, сплавление, разложение под действием высоких температур, давления, высокочастотного разряда; комбинирование различных приемов; особенности разложения органических соединений. Способы устранения и учета загрязнений и потерь компонентов при пробоподготовке.
Особенности пробоподготовки твёрдых, жидких и мягких лекарственных форм в фармацевтическом анализе.
9.Методы качественного анализа неорганических и органических веществ
Качественный анализ, совокупность химических, физико-химических и физических методов обнаружения и идентификации элементов, радикалов, ионов и соединений, входящих в состав анализируемоговещества или смеси веществ. Качественный анализ - один из основных разделов аналитической химии. Важнейшие характеристики методов качественного анализа: 1) специфичность (селективность), т. е. возможность обнаружения искомого элемента в присутствии другого; 2) чувствительность, определяемая наименьшим количеством элемента, которое может быть обнаружено данным методом в капле раствора(0,01–0,03 мл); Качественный анализ неорганических соединений в водных растворах основан на ионных реакциях; в соответствии с этим он разделяется на анализ катионов и анализ анионов. Наиболее часто катионы делят на 5 групп по растворимости их сернистых солей. Анионы обычно классифицируют по различнойрастворимости бариевых или серебряных солей. Если в анализируемом веществе определяют ионы, которые могут быть обнаружены селективными реагентами, то анализ ведут дробным методом
Наряду с классическими химическими методами в качественном анализе широко используют физические и физико-химические (так называемые инструментальные) методы, основанные на изучении оптических, электрических, магнитных, тепловых, каталитических, адсорбционных и др. свойств анализируемых веществ. Эти методы обладают рядом преимуществ перед химическими, т.к. позволяют во многих случаях исключить операцию предварительного химического разделения анализируемой пробы на составные части, а также непрерывно и автоматически регистрировать результаты анализа. Кроме того, при использовании физических и физико-химических методов для определения малых количеств примесей требуется значительно меньшее количество анализируемой пробы.
Качественный анализ органических соединений проводят методами элементного анализа и функционального анализа, а также путем определения основных физико-химических свойств анализируемых веществ.
Типы аналитических реакций и реагентов:
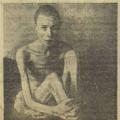 Истребление гитлеровцами советских военнопленных в «Гросс-лазарете Славута» Каменец-Подольской области
Истребление гитлеровцами советских военнопленных в «Гросс-лазарете Славута» Каменец-Подольской области Днепровская воздушно-десантная операция
Днепровская воздушно-десантная операция История военных займов и помощи фронту Работать с удвоенной энергией
История военных займов и помощи фронту Работать с удвоенной энергией